الخلية الجافة هي أبسط أشكال مصادر إنتاج الكهرباء. يشكل عدد من الخلايا مجتمعة الخلايا معًا بطارية. ال حمض الرصاص أو النيكل والكادميوم البطارية هي النسخة المتقدمة من الخلية الجافة. تم اختراع هذه الخلية لأول مرة من قبل المهندس الفرنسي جورج لوكلانش في عام 1866. سمي اختراعه باسم بطارية Leclanche. لكن في ذلك الوقت ، كانت ثقيلة جدًا ويمكن كسرها بسهولة. الخلية الجافة لها نفس المبدأ وهي النسخة المتقدمة من بطارية Leclanche وتأتي بجهد وأحجام مختلفة. تم اختراع الشكل التجاري لخلية الكربون الزنك وهو الشكل المعدل لبطارية Leclanche في عام 1881 بواسطة Carl Gassner of Mainz. يتم إنتاجه بكميات كبيرة ويستخدم في العديد من التطبيقات مثل الألعاب وأجهزة الراديو والآلات الحاسبة وما إلى ذلك.
ما هي الخلية الجافة؟
الخلية الجافة هي جهاز يولد الكهرباء على أساس التفاعلات الكيميائية. عندما يتم توصيل قطبي الخلية عبر مسار مغلق ، فإن الخلية تجبر الإلكترونات على التدفق من طرف إلى آخر. يتسبب تدفق الإلكترونات في تدفق التيار في الدائرة المغلقة.

طبقات الخلايا الجافة
بمساعدة التفاعلات الكيميائية ، تتدفق الإلكترونات من طرف إلى آخر. عندما تتصل خليتان أو أكثر بالقطبية الصحيحة ، يتدفق المزيد من الإلكترونات بسبب الإمكانات العالية. هذا المزيج يسمى البطارية. من الحد الأدنى للجهد 1.5 فولت إلى 100 فولت ، يمكن استخدام بطارية للحصول على نطاق من الفولتية. حتى الجهد الناتج DC للبطارية يمكن تنظيمه إلى مستويات مختلفة باستخدام محولات الطاقة الإلكترونية مثل قاطع متناوب الدوائر.
هيكل الخلية
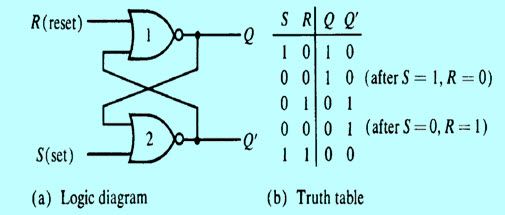
يظهر هيكل الخلية الجافة الزنك والكربون في الشكل. يتكون من طرف الأنود مثل الزنك أو في قضيب الجرافيت العام. يشكل الكربون محطة الكاثود. يمكن ملاحظة أنه في الإصدارات القديمة من الخلية الجافة ، تم استخدام الزنك ككاثود وكان الجرافيت يستخدم كمحطة أنود. يعتمد اختيار العناصر بشكل أساسي على التكوين الكيميائي للمدار الخارجي للعناصر.

هيكل الخلية الجافة
إذا كان لديها عدد أكبر من الإلكترونات في المدار الخارجي ، فيمكنها أن تعمل كمانح ، وبالتالي تشكل الكاثود. وبالمثل ، إذا كان المدار الخارجي يحتوي على عدد أقل من الإلكترونات ، فيمكنه بسهولة قبول القطب الموجب وبالتالي تكوينه. يعمل المنحل بالكهرباء الموجود في الوسط كمحفز للتفاعلات الكيميائية. بشكل عام ، نستخدم هلام كلوريد الأمونيوم كإلكتروليت. في الشكل الموضح ، يكون المنحل بالكهرباء المستخدم عبارة عن خليط من الزنك والكلوريد. أيضًا ، يستخدم كلوريد الصوديوم أيضًا كإلكتروليت. يحيط بقضيب الأنود خليط من ثاني أكسيد المنغنيز والكربون.
يتم وضع التكوين بالكامل في أنبوب معدني. يتم منع الهلام من الجفاف باستخدام طبقة في الجزء العلوي من الخلية. يتم وضع غسالة الكربون في الجزء السفلي. الغرض من هذه الغسالة هو منع أنود الزنك من ملامسة الحاوية.
يسمى هذا أيضًا بالفاصل كما هو موضح في الرسم التخطيطي. علبة الزنك محاطة أيضًا بعزل الورق لأغراض العزل. بالنسبة للبطاريات الكبيرة ، يتم أيضًا استخدام مواد عازلة أخرى مثل الميكا وما إلى ذلك. يتم تشكيل الطرف الموجب لل ell في الأعلى. يتم تشكيل الطرف السالب للخلية في القاعدة.
عمل الخلية الجافة
تعمل الخلية الجافة بشكل أساسي على التفاعلات الكيميائية. بسبب التفاعلات التي تحدث بين الإلكتروليت والأقطاب الكهربائية ، تتدفق الإلكترونات من قطب كهربائي إلى آخر. مواد مثل الأحماض تذوب في الماء لتكوين جزيئات مؤينة. الجسيمات المتأينة من نوعين. تسمى الأيونات الموجبة الكاتيونات والأيونات السالبة تسمى الأنيونات. تسمى الأحماض المذابة في الماء بالكهرباء.
في الرسم البياني المذكور أعلاه ، يتشكل كلوريد الزنك على هيئة إلكتروليت. وبالمثل ، يتشكل هلام كلوريد الأمونيوم أيضًا كإلكتروليت. تشكل القضبان المعدنية المغمورة في الإلكتروليتات أقطابًا كهربائية. بناءً على الخصائص الكيميائية للقضبان المعدنية ، لدينا قطب موجب كقطب موجب وقطب سالب مثل القطب السالب.
تجذب الأقطاب الكهربائية الأيونات ذات الشحنة المعاكسة إلى جانبها. على سبيل المثال ، يجذب الكاثود الأنيونات والأنود يجذب الكاتيونات. في هذه العملية تتدفق الإلكترونات من اتجاه إلى آخر ، وبالتالي نحصل على تدفق للشحنات. هذا يسمي تيار .
التفاعلات الكيميائية
التفاعلات التي تحدث في الخلية موضحة أدناه. الأول هو تفاعل الأكسدة.

في هذا ، يتأكسد كاثود الزنك إلى أيونات زنك موجبة الشحنة تطلق أيونين. يتم جمع هذه الإلكترونات بواسطة الأنود. ثم يأتي رد فعل الاختزال.

يظهر تفاعل الاختزال عند الأنود أعلاه. ينتج هذا التفاعل تيارًا كهربائيًا. يطلق أيونات الأكسيد مع أكسيد المغنيسيوم. يتكون هذا التفاعل عندما يتحد المغنيسيوم مع المنحل بالكهرباء.


يمثل التفاعلان الآخران تفاعلًا حمضيًا قاعديًا وتفاعل ترسيب يحدث في الخلية الجافة. في التفاعل الحمضي القاعدي ، يتم دمج NH4 مع OH لإنتاج NH3 جنبًا إلى جنب مع الماء. النتائج هي NH3 وقاعدة المياه.
الفرق بين الخلية الجافة والخلية الرطبة
الفرق الرئيسي بين الخلية الجافة والخلية الرطبة هو شكل المنحل بالكهرباء. كما نوقش من قبل ، في الخلية الجافة ، يكون المنحل بالكهرباء مثل كلوريد الأمونيوم جافًا في الطبيعة. هذه الخلايا الجافة أكثر شيوعًا وتستخدم في الألعاب وأجهزة الراديو وما إلى ذلك. ولكن في الخلية الرطبة ، يكون المنحل بالكهرباء في الحالة السائلة.
يتم استخدام الإلكتروليتات السائلة مثل حمض الكبريتيك ، وهو سائل خطير مسبب للتآكل. نظرًا لطبيعة هذه السوائل ، تكون الخلية الرطبة أكثر انفجارًا بطبيعتها وتحتاج إلى التعامل معها بحذر. أفضل ميزة لهذه الخلايا الرطبة هي أنها يمكن إعادة شحنها بسهولة واستخدامها في العديد من التطبيقات. تجد مثل هذه البطاريات استخدامًا شائعًا في الطيران والمرافق وتخزين الطاقة وأبراج الهواتف المحمولة.
وظائف الخلايا الجافة
تعتمد وظيفة الخلية الجافة على التفاعلات الكيميائية بين القطب الكهربائي والإلكتروليتات. عندما توضع الأقطاب الكهربائية في الإلكتروليتات ، فإنها تجذب الأيونات ذات الشحنة المعاكسة تجاه نفسها. يؤدي هذا إلى تدفق الشحنات ، وبالتالي يتم إنتاج التيار.
مزايا
ال مزايا الخلية الجافة تشمل ما يلي.
- تتميز الخلية الجافة بالعديد من المزايا مثل
- إنه صغير الحجم.
- يمكن أن يأتي في مجموعة متنوعة من مستويات الجهد.
- إنه سهل الاستخدام وله العديد من التطبيقات.
- إنه المصدر الوحيد لجهد التيار المستمر.
- يمكن استخدامه مع الدوائر الإلكترونية للطاقة لتنظيم جهد الخرج
- إنه قابل لإعادة الشحن.
سلبيات
ال عيوب الخلية الجافة تشمل ما يلي.
- يجب التعامل معها بحذر
- إنه متفجر
- البطاريات ذات التصنيف الكبير ثقيلة جدًا
التطبيقات
ال تطبيقات الخلية الجافة تشمل ما يلي.
- ألعاب الأطفال
- طيران
- هاتف خليوي
- مذياع
- آلة حاسبة
- ساعات
- مساعدات للسمع
ومن ثم فقد رأينا تشغيل وتصنيف وتطبيقات خلايا جافة . نقطة واحدة مثيرة للاهتمام يجب ملاحظتها هي أن البطارية تعمل فقط عندما تكون الأقطاب على اتصال جسديًا ببعضها البعض. يجب أن يكون هناك وسيط موصل بين القطبين. السؤال هو هل يمكن استخدام الماء كوسيط موصل بين أقطاب الخلية الجافة؟ في هذه الحالة ، ماذا سيحدث إذا غُمرت هذه الخلية في الماء؟